Tác giả: Nguyễn Xuân Vũ, Trần Thị Mai, Nguyễn Thị Tình, Ngô Xuân Bình, Nguyễn Tiến Dũng
TÓM TẮT
Nắng nóng là một trong những nguyên nhân chính gây ảnh hưởng đến năng suất và sản lượng cây trồng. Đặc biệt, từ giai đoạn hình thành hạt phấn đến ra hoa nếu gặp nhiệt độ cao năng suất sẽ giảm nghiêm trọng do hạt phấn mất khả năng nảy mầm và hạt không được hình thành. Gen AtHSP101 mã hóa cho Chaperon protein B1 (ClpB1) thuộc nhóm protein chịu nhiệt heat shock protein 100 (HSP100) có vai trò nâng cao tính chống chịu của tế bào trong những điều kiện bất lợi như hạn, lạnh, nóng,… Các nghiên cứu đã chứng minh gen AtHSP101 được biểu hiện mạnh ở cơ quan sinh sản như hoa, hạt phấn, hạt của cây. Với mục tiêu đưa gen AtHSP101 vào trong cây để tăng cường khả năng chịu nóng của hạt phấn và các cơ quan sinh sản khác chúng tôi tiến hành tách dòng gen AtHSP101 từ cây Arabidopsis thaliana và thiết thiết kế vector phục vụ nghiên cứu chuyển gen. Kết quả đã tách dòng thành công gen AtHSP101 có kích thước 2.736kb từ cDNA bằng vector tách dòng pBluescript. Kết quả tách dòng gen được kiểm tra bằng giải trình tự gen và enzyme cắt giới hạn AscI và SpeI. Gen AtHSP101 sau đó được đưa vào vector biểu hiện pER8 điều khiển bởi promoter UBQ14 để sử dụng cho nghiên cứu tạo cây trồng chuyển gen chịu nóng ở Việt Nam.
Từ khóa: AtHSP101, chịu nóng, tách dòng, vector.
Protein sốc nhiệt (Heat Shock Protein-HSP) có vai trò quan trọng giúp tế bào sinh vật chống lại những điều kiện bất lợi (stress) của môi trường sống. Tùy theo khối lượng phân tử, HSP được chia thành các nhóm khác nhau gồm HSP27, HSP60, HSP70, HSP90, HSP100, HSP101, HSP104,.. và có vai trò nhất định giúp tế bào phản ứng lại các tác động bất lợi như nóng, hạn, lạnh,… [6], [8], [11], [12]. Các nghiên cứu cho thấy HSP được tổng hợp ở tất cả các sinh vật, tuy nhiên việc xác định loại protein nào có vai trò chống chịu điều kiện bất lợi cần phải phân tích chi tiết ở mức độ phân tử [6], [8]. Gen HSP101 đã được Queitsch và cộng sự (2000) [11] chứng minh có vai trò quan trọng giúp tế bào có khả năng chịu nóng ở cây Arabidopsis. Nghiên cứu chỉ ra rằng cây chuyển gen HSP101 dưới sự kiểm soát của promoter 35S có khả năng chống chịu ở 45oC trong khi đó cây đối chứng chết ở 38oC [11]. Cây chuyển gen không bị ảnh hưởng đến khả năng sinh trưởng, phát triển khi gen HSP101 được điều khiển bới các promoter cơ định như 35S hoặc Ubi [2], [7], [11]. Mặt khác, khi gen HSP101 bị bất hoạt hoặc kìm hãm thì các cây Arabidopsis và cây ngô không có khả năng chịu nhiệt. Ở các nghiên cứu khác, gen HSP101 được Agarwal và cộng sự (2002) [7] chuyển vào cây lúa indica thông qua vi khuẩn, các cây chuyển gen có khả năng chịu nóng ở 45oC sau 3h xử lý ở giai đoạn cây con [7]. Tương tự Chang và cộng sự (2007) [2] đã chuyển gen HSP101 dưới sự điều khiển của promoter 35S vào cây lúa nhận thấy khả năng chịu nóng được nâng lên rõ rệt ở các cây chuyển gen. Ngoài ra, khi phân tích biểu hiện HSP101 ở cây thuốc lá nhóm tác giả nhận thấy hàm lượng enzyme luciferase tăng gấp 2,9 lần so với cây không chuyển gen. Tác giả cho rằng gen HSP101 có thể sử dụng làm chỉ thị chọn lọc cây chuyển gen ở thuốc lá [2]. Các kết quả nghiên cứu trên chứng tỏ gen HSP101 có vai trò rất quan trọng đến khả năng chịu nóng của cây.
Ở Việt Nam công tác chọn tạo giống cây trồng chịu nóng đã được một số nhà khoa học quan tâm nghiên cứu gần đây như Nguyen Thi Lang và cộng sự (2015) [8], Bùi Chí Bửu và cộng sự (2016) [1] đã ứng dụng chỉ thị MAS kết hợp với lai hồi quy để chọn lọc các dòng lúa có khả năng chịu nóng cho các tỉnh Đồng Bằng Sông Cửu Long. Tuy nhiên, việc sàng lọc các gen chịu nóng để làm nguyên liệu cho chuyển gen còn rất hạn chế. Trong phạm vi bài báo này chúng tôi tiến hành tách dòng gen AtHSP101 từ cây Arabidopsis thaliana và thiết kế vector biểu hiện gen ở cây trồng để phục vụ cho nghiên cứu tạo cây chuyển gen chịu nóng ở Việt Nam.
Vector tách dòng pBluescript và vector chuyển gen pER8 do giáo sư Park Soon Ki, trường Đại học Quốc gia Kyungpook, Hàn Quốc cung cấp trong khuôn khổ hợp tác với trường Đại học Nông Lâm Thái Nguyên.
2.2.1. Tách chiết RNA tổng số và khuếch đại gene từ cDNA
RNA tổng số được tách từ nụ hoa cây Arabidopsis thaliana bằng bộ kít RNeasy Plant Mini của hãng Qiagen (http://www.qiagen.com/). Quy trình tách chiết được thực hiện theo hướng dẫn của nhà sản xuất. Nồng độ RNA tổng số được đo bằng máy quang phổ kế Biorad Specphotometer ở bước sóng OD260/280. 1ug RNA tổng số được dùng làm khuôn để tổng hợp cDNA theo hướng dẫn của bộ kít ImpromII Reverse transcription System hãng Promega (https://worldwide.promega.com). cDNA sau khi tổng hợp được sử dụng làm khuân cho phản ứng PCR khuếch đại gen AtHSP101 với cặp mồi đặc hiệu AtHSP101-NF và AtHSP101-SR (Bảng 1). Phản ứng được thực hiện trong 25 chu kỳ ở 94oC: 2 phút, 55oC: 30 giây, 72oC: 2 phút. Sản phẩm PCR được kiểm tra trên gel agarose và tinh sạch bằng bộ kít PCR purification của hãng SolGent (http://www.solgent.com).
2.2.2. Gắn vào vector tách dòng
Để tách dòng gene AtHSP101 chúng tôi sử dụng vector nhân dòng pBluescript có chứa promoter UBQ14 được cung cấp bởi giáo sư Park Soon Ki trường Đại học quốc gia Kyungpook Hàn Quốc. Toàn bộ chiều dài gen AtHSP101 mã hóa được khuếch đại bằng PCR với cặp mồi đặc hiệu có chèn vị trí nhận biết của 2 enzyme tương ứng là NotI và SpeI, ký hiệu là AtHSP101-NF và AtHSP101-SR (Bảng 1). Sản phẩm PCR nhân gen AtHSP101 và vector tách dòng pBluescript được cắt đồng thời bằng hai enzyme NotI và SpeI của hàng BioLabs (https://www.neb.com). Sản phẩm cắt sau đó được tinh sạch bằng kit của hãng SolGent (http://www.solgent.com) và ghép nối bằng enzyme T4 ligase. Phản ứng ghép nối được thực hiện ở nhiệt độ phòng trong 12h với thể tích 10 µl bao gồm: DNA chèn + DNA vector + 1µl T4 DNA ligase. Sản phẩm ghép nối sau đó được biến nạp vào tế bào E.coli DH5α khả biến theo phương pháp sốc nhiệt ở 42oC, 30 giây. Tế bào biến nạp được nuôi qua đêm ở 37oC trên môi trường LB (Luria-Bertani gồm 10 g/l NaCl, 10 g/l trytone, 5 g/l yeast extract, 15 g/l agar) bổ sung kháng sinh ampicillin 100 mg/l.
2.2.3. Chọn lọc dòng tế bào tái tổ hợp
Tế bào tái tổ hợp được sàng lọc bằng PCR với cặp mồi đặc hiệu từ các khuẩn lạc (colony) mọc trên đĩa môi trường LB chứa kháng sinh ampicillin 100 mg/l. Tiếp đến tế bào tái tổ hợp được nuôi tăng sinh, tách plasmid để kiểm tra các đoạn chèn bằng enzyme cắt hạn chế và giải trình tự gen. Trình tự gen sau đó được kiểm tra bằng cách so sánh với trình tự gen gốc trên ngân hàng gen NCBI bằng công cụ BLAST. Trình tự tách dòng hoàn hảo được gắn vào vector chuyển gene.
2.2.4. Gắn vào vector chuyển gen
Vector biểu hiện pER8 được sử dụng để chuyển gen AtHSP101 vào cây trồng. Cấu trúc gen pUBQ14::AtHSP101 và vector pER8 được cắt đồng thời bằng enzyme AscI và SpeI sau đó ghép nối bởi enzyme T4 DNA ligase. Phản ứng ghép nối tạo cấu trúc pER8-pUBQ14::AtHSP101 được tiến hành tương tự như trình bày ở phần tách dòng gen. Sản phẩm ghép nối được chuyển vào tế bào vi khuẩn E.coli DH5α và nuôi cấy trên môi trường LB đặc bổ sung 50 mg/l kanamycin. Tế bào tái tổ hợp được kiểm tra bằng PCR và enzyme cắt giới hạn. Để chuyển vào cây trồng, plasmid tái tổ hợp được chuyển vào tế bào vi khuẩn GV3101
3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Phân tích gen AtHSP101 trên cơ sở dữ liệu database
Gen AtHSP101 được phân lập từ cây Arabidopsis thaliana có mã số At1g74310.1, mã hóa cho Chaperon protein B1 (ClpB1) thuộc nhóm protein chịu nhiệt heat shock protein 100. Để sơ bộ đánh giá mức độ biểu hiện của gene AtHSP101 chúng tôi sử dụng công cụ hỗ trợ phân tích trực tuyến eFP brower gene expression (http://bar.utoronto.ca/efp/cgi-bin/efpWeb.cgi). Mức độ biểu hiện của gen được phân tích ở tất cả các mẫu mô dựa trên phần mềm GeneChip Operating Software (GCOS). Kết quả cho thấy gen AtHSP101 có mức độ biểu hiện cao ở các cơ quan sinh sản như nụ hoa, hạt phấn và hạt (Hình 1A). Trong đó hạt chín có mức độ biểu hiện gen cao nhất, tín hiệu biểu hiện là 1908,95. Tiếp đến là cánh hoa và hạt non, lần lượt đạt 1656,63 và 1472,1. Gen AtHSP101 gần như không biểu hiện ở các cơ quan sinh dưỡng như lá (2.1), thân lá (19,46) (Hình 1A). Dựa trên nghiên cứu của Kilian và cộng sự (2007) đánh giá mức độ biểu hiện gen trong điều kiện bất lợi của môi trường cho thấy gen AtHSP101 biểu hiện mạnh sau 1-3h xử lý ở 38 oC [8]. Điều này chứng tỏ khi gặp điều kiện nhiệt độ cao, gen AtHSP101 được tăng cường biểu hiện để bảo vệ tế bào và gia tăng khả năng chịu nhiệt của cây (Hình 1B). Dựa trên các cơ sở dữ liệu và kết quả nghiên cứu cho thấy gen AtHSP101 là một trong ứng viên có khả năng tăng cường tính chịu nhiệt ở cây trồng.
.jpg)
Hình 1: Biểu hiện của gen AtHSP101 ở cây Arabidopsis thaliana (Winter et al. 2007) [16]
3.2. Tách dòng gen AtHSP101
Dựa trên kết quả phân tích chúng tôi tiến hành tách dòng gen AtHSP101 để ứng dụng cho chuyển gen. Bằng phản ứng trùng hợp chuỗi (PCR) với cặp mồi đặc hiệu AtHSP101-NF và AtHSP101-SR toàn bộ chiều dài 2.736 bp trình tự gene mã hóa (coding sequences-CDS) được khuếch đại trên khuân cDNA. Sản phẩm PCR được tinh sạch bằng bộ kít của hãng Solgent (http://www.solgent.com) để sử dụng cho tách dòng gen. Sử dụng vector tách dòng pBluescript mang promoter UBQ14 đã được chèn vào vị trí giữa AscI và NotI (Hình 2A). Gen AtHSP101 được đưa vào vị trí giữa hai enzyme NotI và SpeI sau khi được cắt và nối bằng enzyme T4 DNA ligase (Hình 2A). Kết quả tách dòng gen được kiểm tra ở các khuẩn lạc (colony) trên môi trường LB đặc có kháng sinh chọn lọc Ampicilin 100mg/l. Sau khoảng 16h nuôi cấy ở nhiệt độ 37 oC, chúng tôi kiểm tra ngẫu nhiên 16 khuẩn lạc bằng kỹ thuật PCR tại chỗ với cặp mồi T3 và AtHSP101-F1. Kết quả phân tích sản phẩm PCR trên gel agarose 0,8% cho thấy đường chạy số 1, 2, 8 và 13 cho duy nhất 1 băng kích thước khoảng 1,63 kb, các đường chạy còn lại hoặc không có băng vạch hiển thị (đường số 3 và 4), hoặc có 2 băng không đặc hiệu (Hình 3A). Chúng tôi nhận định khuẩn lạc số 1, 2, 8 và 13 có thể mang plasmid tái tổ hợp chứa gen AtHSP101. Để có kết quả chính xác hơn, khuẩn lạc số 8 và 13 được nuôi tăng sinh và tách plasmid DNA kiểm tra. Đoạn gen chèn AtHSP101 được kiểm tra bằng enzyme AscI và SpeI. Kết quả cắt cho thấy cả 2 plasmid cho 2 đoạn kích thước 3,736 kb và 3.0 kb (Hình 3B) tương ứng với kích thước của gen pUBQ14::AtHSP101 và vector pBluescript. Khả năng tách dòng thành công phải đảm bảo trình tự gen được nguyên vẹn, không có sự sai khác về trình tự amino axit mã hóa. Để kiểm tra, chúng tôi gửi mẫu plasmid DNA đi giải trình tự bở công ty COSMOGENTECH (http://www.cosmogenetech.com) của Hàn Quốc với 4 mồi, gồm T3 (-40), AtHSP101- R1,- R2,- R3. Kết quả giải trình tự được so sánh trên ngân hàng gen NCBI cho thấy gen AtHSP101 có độ tương đồng 100% với mã số NM106091.4 và trình tự amino axit được bảo toàn. Hình 4-A và B thể hiện một phần kết quả tách dòng gen AtHSP101 được kiểm tra bằng công cụ Blast trên ngân hàng gen (NCBI) với mồi ngược T3 (-40) cung cấp bởi công ty COSMOGENTECH (Hình 4 A). Đồ thị tín hiệu tốt (Hình 4B). Trình tự gen AtHSP101 bắt đầu từ vị trí 366, xen giữa vị trí từ 360 đến 365 là trình tự enzyme SpeI (ACTAGT) nối giữa gen AtHSP101 và vector pBluescipt (Hình 4A, B). Từ các kết quả thu được chúng tôi khẳng định gen AtHSP101 được tách dòng thành công, ký hiệu là pBluescript::AtHSP101-8.
Bảng 1. Trình tự mồi sử dụng trong nghiên cứu
|
Tên mồi |
Trình tự (5’-3’) |
|
AtHSP101-NF |
AAG GCG GCC GCA TGA ATC CAG AGA AAT TCA C |
|
AtHSP101-SR |
ACT ACT AGT TTA ATC CTC GAT CAT TTC CTC |
|
AtHSP101-F1 |
CAC GAG GAA GGT GGA CAA CTA ACT G |
|
AtHSP101-R1 |
CGA GTT CCT GAA ATC GAC TCT CCT G |
|
AtHSP101-R2 |
ACC TCT ATA AGT CGA GCT TTG CTG G |
|
AtHSP101-R3 |
AAC TAA CGC ACC CAT GTC CAA CG |
|
PER8-R |
ACG TTG TCG AAA CCG ATG ATA CGG |
.jpg)
Hình 2. Hình vẽ cấu trúc vector nhân dòng và vector chuyển gen
(A)-vector nhân dòng pBluscipt được cắt mở vòng và chèn đoạn gen pUBQ14::HSP101 tại vị trí enzyme cắt giới hạn AscI và SpeI trong vùng MCS.
(B)-vector chuyển gen pER8 được chèn cấu trúc pUBQ14::AtHSP101 có gen chỉ thị chọn lọc kanamycin trong vùng RB và LB.
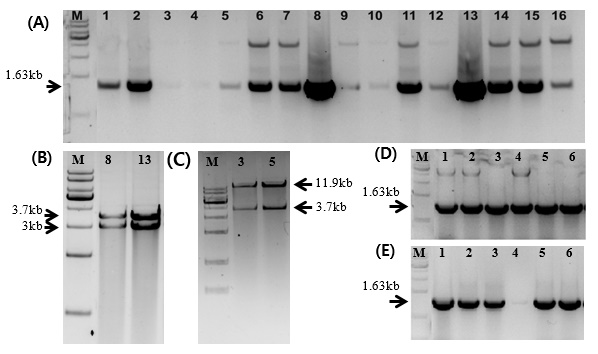
Hình 3. Kết quả kiểm tra khuẩn lạc bằng PCR và enzyme cắt giới hạn
(A)- PCR khuẩn lạc để chọn khuẩn lạc tái tổ hợp pBluesctipt-UBQ14::AtHSP101 sử dụng cặp mồi T3 và AtHSP101-F1. Mũi tên chỉ đoạn khuếch đại kích thước khoảng 1.63kb tương ứng với kích thước mong muốn.
(B)- Kiểm tra đoạn chèn bằng enzyme cắt hạn chế AscI và SpeI cho hai đoạn 3kb và 3.7kb tương ứng với kích thước vector pBluescript và UBQ14::AtHSP101.
(C)- Kiểm tra đoạn chèn bằng enzyme cắt hạn chế AscI và SpeI cho hai đoạn 11.9kb và 3.7kb tương ứng với kích thước vector pER8 và UBQ14::AtHSP101.
(D) và (E)- PCR khuẩn lạc để chọn khuẩn lạc tái tổ hợp pER8-UBQ14::AtHSP101 sử dụng cặp mồi pER8-R và AtHSP101-F1. Mũi tên chỉ đoạn khuếch đại kích thước khoảng 1.63kb tương ứng với kích thước mong muốn.
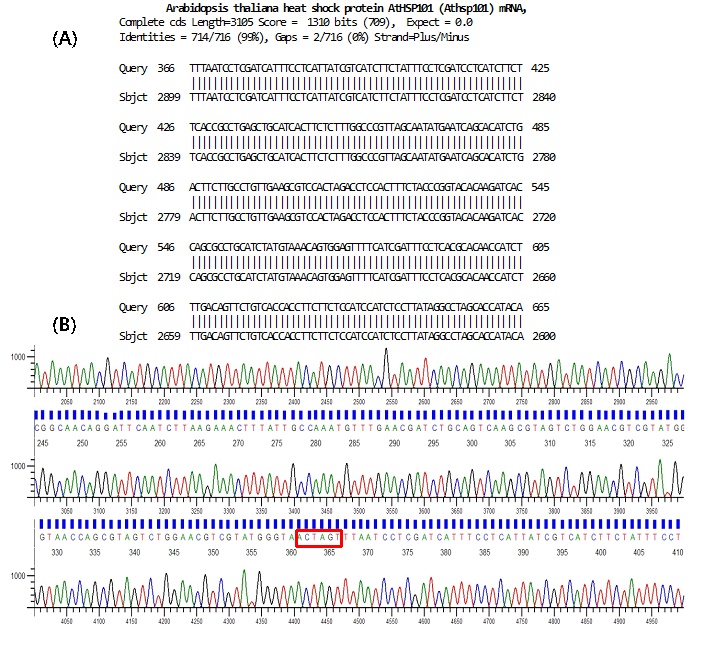
Hình 4. Kết quả giải trình tự gen tách dòng AtHSP101 với cặp mổi ngược T3 (-40)
(A)- Trình tự gen tách dòng gene AtHSP101 sau khi giải trình tự được kiểm tra bằng phần mềm Blast trên NCBI;
(B)- Đồ thị tín hiệu kết quả giải trình tự gen AtHSP101.
Trình tự nucleotid trong hộp màu đỏ là vị trí enzyme cắt SpeI nối giữa gen AtHSP101 và vector pBluescript tương ứng với Hình 2-A.
3.3. Gắn vào vector chuyển gen
Sau khi tách dòng thành công, gen AtHSP101 được đưa sang vector chuyển gen pER8 kích thước 11,9kb có các vị trí enzyme cắt giới hạn AscI và SpeI. Cắt đồng thời pBluescript::AtHSP101-8 và pER8 vector với enzyme AscI và SpeI và ghép nối bằng enzyme T4 DNA ligase theo sơ đồ mô tả ở hình 2A và 2B. Phản ứng ghép nối được biến nạp vào tế bào khả biến E.coli DH5α và nuôi cấy trải trên đĩa thạch có kháng sinh chọn lọc kanamycin 50mg/l. Kết quả kiểm tra ngẫu nhiên 6 khuẩn lạc bằng PCR sử dụng cặp mồi AtHsp101-F1 và pER8-R cho thấy cả 6 khuẩn lạc có kích thước khoảng 1.63 kb (Hình 3D) tương ứng với đoạn gen khuếch đại bằng cặp mồi AtHSP101-F1 và pER8-R. Trong đó, các khuẩn lạc số 1, 2 và 4 có thêm một băng không đặc hiệu khoảng trên 5kb vì thế chúng tôi loại bỏ các khuẩn lạc này. Để chắc chắn, chúng tôi nuôi tăng sinh khuẩn lạc số 3 và 5 sau đó tách plasmid DNA để kiểm tra bằng enzyme cắt hạn chế. Kết quả cắt bằng enzyme AscI và SpeI cho thấy, trên bản điện di xuất hiện 2 băng kích thước khoảng 11.9 kb và 3.7 kb (Hình 3C) tương ứng với kích thước của vector pER8 và đoạn chèn promoter-gene UBQ14::AtHSP101. Từ các kết quả thu được chứng tỏ gen AtHSP101 đã gắn thành công vào vector chuyển gen pER8.
Để đánh giá khả năng biểu hiện gen AtHSP101 trên cây cây mô hình Arabidopsis, chúng tôi tiến hành đưa vector chuyển gen pER8-UBQ14::AtHSP101 vào chủng vi khuẩn GV3101. Kết quả kiểm tra ngẫu nhiên 6 khuẩn lạc trên môi trường kháng sinh rifampicin, spectinomycin và gentamycin cho thấy hầu hết các khuẩn lạc đều dương tính với cặp mồi AtHSP101-F1 và pER8-R cho kích thước gen khoảng 1,63 kb (Hình 3E). Từ các kết quả trên chứng tỏ gen AtHSP101 đã được gắn vào vector chuyển gen và biến nạp vào vi khuẩn sẵn sàng cho các thí nghiệm chuyển gen. Để khẳng định khả năng ứng dụng của gen AtHSP101 trên cây trồng, chúng tôi đang tiến hành thử nghiệm trên cây mô hình Arabiopsis. Kết quả nghiên cứu sẽ được trình bày ở các công bố tiếp theo.
4. KẾT LUẬN
Tách dòng thành công gene AtHSP101 và thiết kế vector pER8-pUBQ14::AtHSP101 phục vụ công tác chuyển gen trên cây trồng như cà chua, khoai tây, lúa,...
TÀI LIỆU THAM KHẢO
[1]. Bùi Chí Bửu, Nguyễn Thị Lang và công sự (2016) Chọn tạo giống lúa chống chịu nóng bằng chỉ thị phân tử. Hội thảo Quốc gia về Khoa học Cây trồng lần thứ hai, 235-245.
[3]. Endo M, Tsuchiya T, Hamada K, Kawamura S, Yano K., Ohshima M (2009) High temperatures cause male sterility in rice plants with transcriptional alterations during pollen development. Plant Cell Physiol. 50: 1911–1922.
[6]. Hu W, Hu G and Han B (2009) Genome-wide survey and expression profiling of heat shock proteins and heat shock factors revealed overlapped and stress specific response under abiotic stresses in rice. Plant Sci. 176: 583–590.
[8]. Kilian J, Whitehead D, Horak J, Wanke D, Weinl S, Batistic O, D'Angelo C, Bornberg-Bauer E, Kudla J, Harter K. (2007) The AtGenExpress global stress expression data set: protocols, evaluation and model data analysis of UV-B light, drought and cold stress responses. Plant J. 2:347-63.
[11]. Prasad PVV, Boote KJ, Allen LH, Sheehy JE, and Thomas JMG (2006). Species, ecotype and cultivar differences in spikelet fertility and harvest index of rice in response to high temperature stress. Field Crops Res. 95: 398-411.
CLONING AND CONSTRUCTION OF EXPRESSION VECTOR CARRYING ATHSP101 USED FOR HEAT TOLERANT PLANT TRANSFORMATION IN VIETNAM
Nguyễn Xuân Vũ1, Trần Thị Mai1, Nguyễn Thị Tình1, Ngô Xuân Bình1,2, Nguyễn Tiến Dũng1*
Summary
Heat stress is one of the major factors causing the reduction of seed yield and production. The pollen development and flowering stages were the most sensitive to heat stress that inhibit the pollen germination. AtHSP101 gene encodes the Chaperon protein B1 (ClpB1) which belongs to the heat shock protein 100 (HSP100) family required for accumulation for abiotic stress such as drought, low and high temperature. Microary database showed that AtHSP101 preferred expressed in reproductive organs such as pollen grain, seed... In order to develop heat tolerant plant throught gene transformation approach we cloned AtHSP101 gene from Arabidopsis thaliana and created the expression vector for plant transformation. The AtHSP101 gene was amplified from its cDNA with 2.736kb and introduced into a cloning vector pBluescript. Results of cloning were confirmed by sequencing and digestion with AscI and speI enzymes. Finaly, AtHSP101 was transferred to an expression vector pER8 under the control of UBQ14 promoter that can be used for generating heat tolerant plants by transformation approach in Vietnam.
Keywords: AtHSP101, Cloning, heat tolerance, vector.
1. Faculty of Biotechnology and Food technology, Thai Nguyen University of Agriculture and Forestry.
2. Department of Science and Technology for Economic Technical Branches, Ministry of Science and Technology
Người đăng: Bùi Đình Lãm

| Đang online | 1057 |
| Hôm nay | 2174 |
| Hôm qua | 1533 |
| Tuần này | 19479 |
| Tuần trước | 33520 |
| Tháng này | 4478354 |
| Tháng trước | 3517132 |
| Tất cả | 51756572 |
Lượt truy cập: 51756591
Đang online: 1059
Ngày hôm qua: 1533
Phụ trách kỹ thuật: 0987. 008. 333